에너지와 엔트로피
2021. 1. 13. 07:29ㆍ자유 게시판
에너지 보존의 법칙.
대기압 하에서 섭씨 0도의 얼음에 열을 가하면 온도는 올라가지 않고 계속 얼음이 녹아 물이 된다. 또 물에 계속 열을 가하면 섭씨 100도의 물이 되고 더 열을 가해도 온도는 오르지 않고 물이 기체로 변한다. 그 동안 열이 한 일은 어떻게 된 것일까? 이런 문제를 다루는 것을 열역학이라고 부른다.
열은 어떻게 이동되는 것일까? 뉴턴 때까지는 열의 본질은 물질입자의 운동으로 생각했으나 18세기에 이르러서는 열의 전달은 칼로릭(caloric)이라는 '무게가 없는 물질 입자'를 흡수하거나 방출해서 생기는 것이라고 생각하게 되었다. 카르노(Sadi Carnot, 1796-1832)는 열기관의 열효율을 연구하면서 열효율은 열기관을 구성하는 두 온도만의 함수가 된다는 생각을 발표하였다. 이에 기반해서 후에 그는 다음과 같은 카르노의 정리를 발표했다.
두 열원 사이에 작용하는 사이클 중 그 열효율이 최대인 것은 가역(可逆)사이클인데, 그 열효율은 두 열원의 절대온도에 의해서만 정해지며 작업물질과는 관계가 없다. 이상기체(理想氣體)인 경우 고온열원(高溫熱源)의 절대온도를 T1, 저온열원의 절대온도를 T2라 하면, 그 열효율은 (T1-T2)/T1로 주어진다. 이 정리는 열역학 제1법칙 및 제2법칙으로부터 얻어진 것이다.
1. 에너지는 무엇인가?
가. 몇 가지 정의
(1) 국제 단위계(System International)
국제적으로 표준화한 단위를 말하며 시간에는 초(sec), 길이에는 미터(m), 질량에는 킬로그램(kg)을 쓴다.
(2) 속도와 가속도
질점(質點) 또는 물체의 단위시간당 움직인 거리를 속도라하며 방향을 생각하지 않을 때는 속력, 방향을 고려하면 속도라한다. 단위는 m/sec이다 . 가속도란 일반적으로 단위시간 내의 속도의 변화량을 말한다. 단위는 m/sec2
(3) 힘(Force)
정지하고 있는 물체를 움직이고, 움직이고 있는 물체의 속도나 운동방향을 바꾸는 작용을 힘이라하며. 물리학에서는 작용이 일어나는 원인이나 나타나는 방식에 따라 전기력·중력(重力)·핵력(核力)·구심력(求心力) 등이라 한다.
힘의 단위는 뉴턴(N) 이고 1N은 1kg의 질량을 가진 물체에 가속도를 주는 힘을 말한다.
(4) 일(Work)
물체에 작용한 힘과, 그 힘의 방향으로 움직인 물체의 이동 거리의 곱을 일(work)이라 한다.
나. 에너지
물체가 지니고 있는 물리적인 일을 할 수 있는 능력을 에너지라고 한다.
실생활에서는 전용되어 생활력이나 동력 등에 대해서도 사용된다. 물체가 E라는 크기의 일을 할 수 있는 상태에 있을 때, 이 물체는 E라는 크기의 에너지를 지니고 있다고 한다.
예를 들면, 높은 곳에 있는 물체가 낙하하면 다른 물체에 힘을 미쳐서 일을 하며, 또 어떤 속도로 운동하고 있는 물체는 그 운동을 방해하려는 다른 물체에 힘을 미쳐서 일을 할 수 있다.
즉, 높은 곳에 있는 물체는 지상에 있는 물체에 비해서, 또 운동체는 정지해 있는 물체에 비해서 보다 큰 일을 할 수 있는 가능성을 지니고 있다.
이것을 물리학에서는 높은 곳에 있는 물체는 높이에 상응하는 위치에너지(E=mgh)를 가지고 있으며, 운동체는 그 속도에 의해서 결정되는 운동에너지(E=(1/2)mv2)를 가지고 있다고 한다.
탄성체(彈性體)의 변형에너지를 비롯하여 열에너지 ·전자기적 에너지 등, 자연계에는 여러 가지 물리적 상태에 따라 그 크기가 결정되는 많은 에너지가 있다.
또 물질 내에 보유되어 있어 화학변화에 따라 방출되는 화학에너지, 원자핵의 변환에 따라 나타나는 원자에너지 등, 물질의 화학적 결합상태나 원자핵 속에 있는 핵자(核子)의 결합상태에 대응하는 에너지도 생각할 수 있다.
【에너지의 변환】
에너지는 상호간에 서로 변환할 수 있다. 예를 들면, 높은 곳에 있는 물의 위치에너지는 낙하함으로써 운동에너지로 변하고, 이것으로 발전기를 회전시키면 전기에너지로 변환된다. 또 전기에너지는 전동기를 통해서 운동에너지로 변하고, 전열기(電熱器)나 전등 등을 통해서 열에너지나 빛에너지로 변한다.
또 동물의 체내에서는 물질의 화학적 변화에 의해 생긴 열에너지가 끊임없이 역학적 에너지 또는 전기적 에너지로 변환되고 있다.
독일의 의사이며 물리학자인 마이어(Robert Mayer, 1814-1878)는 1842년 열대지방에서 선상 근무 중 열대인들의 정맥피가 유럽인보다 매우 빨간 것을 보고 그 이유를 사람들이 음식물을 먹으면 그것이 산소와 반응해서 몸의 열이 되고 그 열이 다시 역학적 에너지로 소모되는데, 열대인들은 역학적 에너지의 소모가 적어서 정맥 피 속에 산소가 더 많이 남아 있기 때문이라고 말했다. 이것은 음식물의 화학 에너지, 열, 역학적 에너지(일) 등이 상호변환이 가능한 것을 시사해 주는 관찰이었다.
그러나 이와 같은 에너지의 상호변환이 반드시 완전무결하게 이루어지는 것은 아니다.
보통 에너지 변환장치에서는 에너지의 변환율을 효율(效率)이라고 하는데, 효율이 100 %에 가까운 것은 수력발전기 정도이고, 그 밖의 것은 효율이 훨씬 떨어진다. 특히 예전부터 사용되어 온 원동기인 열기관은 효율이 대단히 낮아서, 받아들인 열에너지 중에서 불과 35 %만이 기계적인 동력(운동에너지)으로 변할 따름이다.
이것은 운동에너지를 열에너지로 바꾸는 일(예를 들면, 마찰에 의해서)은 쉬우나, 반대로 열에너지를 전부 역학적인 일로 바꾸는 것은 원리적으로 불가능하기 때문이다.
일반적으로 에너지는 그 형태를 바꾸어도 변환의 전후를 통해서 그 총량은 변하지 않고 유지되지만, 이 상호변환은 반드시 가역적(可逆的)인 것만은 아니다. 이 관계는 이론상 열역학 제1법칙 및 제2법칙으로서 정식화되어 있다.
2. 에너지 보존의 법칙
에너지는 그 형태를 바꾸거나 물체에서 물체로 옮기거나 해도 전체의 양에는 변함이 없다는 물리법칙을 말한다.
물질 및 장(場)으로 이루어진 물리학적 체계에 대한 가장 기본적인 물리법칙의 하나이다. 닫힌 계가 가지는 에너지 총계는 어떤 물리화학적 변화가 일어나도 불변임을 의미하며, 외계에서 고립되어 서로 보존력을 미치고 있는 질점계(質點系)가 가지는 전(全)에너지는 운동에너지 Σ(1/2)mv2(m은질점의 질량, v는 속도)와 질점의 위치만으로 정해지는 위치(퍼텐셜)에너지의 합으로 표시된다.
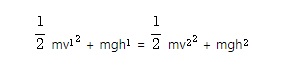
즉, 중력(重力)이나 정전기력(靜電氣力) 등 물체(또는 대전입자)에 작용하는 힘이 물체의 위치만으로 정해질 때에는 그 물체의 위치에너지가 감소하면 그 몫만큼 운동에너지가 증가하고, 반대로 운동에너지가 감소하면 그 몫만큼 위치에너지로 저장되어 위치에너지와 운동에너지의 합은 늘 일정하게 유지된다.
【역학적 에너지 보존】
일반적으로 운동체의 위치에너지와 운동에너지는 서로 전환할 수 있으며, 외력이 작용하지 않는 한 서로 전환하여 그 합은 항상 일정하게 유지된다.
진자의 운동을 예로 들면, 추의 운동에너지는 가장 낮은 위치에서 최대가 되고 가장 높은 위치에서 최소가 되어 양쪽 에너지의 합은 일정하게 유지된 채 운동이 계속된다(이때 공기의 저항은 생각하지 않는다). 이러한 관계를 역학적 에너지보존법칙이라 하며, 이 법칙이 성립하는 역학계를 보존계(保存系)라 한다.
진자의 운동 외에 용수철의 진동도 전형적인 예이다. 그러나 이 경우의 에너지보존법칙은 역학적 과정에 한해 성립되는 것이며, 여기에 다른 형태의 에너지(열 ·전기 등)가 관여할 때는 성립하지 않는다.
이 난점을 극복하고 에너지 변화과정을 모든 에너지로 확장하여 보존법칙이 모든 에너지에 대하여 성립한다고 하는 것이 열역학 제1법칙이다. 이 법칙은 물리학 전반에 걸쳐 성립하는 기본법칙으로 인정한다.
퀴즈: 더 빨리 떨어지는 포탄
높은 언덕에서 그림과 같이 대포를 쏜다.
연직상향 방향과, 연직 아래 방향, 그리고 수평으로 같은 속도의 포탄을 쏜다고 할 때 지면을 때리기 직전의 속도가 가장 큰 경우는 어떤 것인가?(공기저항은 고려하지 않는다)
1) 위로 쏜 포탄
2) 수평으로 쏜 포탄
3) 아래로 쏜 포탄
4) 위로 쏜 포탄과 아래로 쏜 포탄
5) 모두 같은 속도로 떨어진다.
해석:

포탄이 포에서 쏘아지는 순간의 포탄이 가지고 있는 에너지는 세 경우 모두 같다. 같은 높이(같은 위치에너지)에서 같은 속도(같은 운동에너지)로 쏘았기 때문이다. 마찬가지로 세포탄 모두 바닥에 떨어질 때 속도도 모두 같다. 왜냐하면 운동에너지와 위치에너지를 더한 값인 역학적 에너지가 운동의 모든 과정에서 같기 때문이다. 이것은 역학적 에너지 보존법칙 때문이다.
따라서 같은 높이(바닥)이므로 위치에너지가 모두 같고 역학적 에너지가 보존되므로 세 경우 모두 같은 속도(같은 운동에너지)로 바닥을 때릴 것이다. 결과적으로 그림에서 보는 바와 같이 최종 속도는 초기던진 속도와 높이에만 관계되지 던지는 방향과는 관계가 없다.
(문제출처:The Physics Teacher 1987.8)
가. 열역학 제1 법칙
간단히 말하면 일과 열이 서로 같은 종류의 양이고 서로 변환되며 그 힘은 보존된다는 에너지 보존의 법칙이다. 열이 에너지의 한 형태라는 사실에 기초를 두어 이제까지 역학적 에너지 계에만 국한해서 생각해 오던 에너지보존법칙을 열 현상에까지 확장한 법칙을 말한다.
즉, 열과 역학적 에너지를 동등한 입장에서 다루어 이 두 가지 형태의 에너지를 합한 에너지의 보존법칙이다.
어떤 물질계가 한 상태에서 다른 상태로 변할 때, 그 사이에 얻어진 총 에너지는 외부에서 하여진 역학적 일 W와 외부에서 들어온 열량 Q의 합 W-Q와 같고, 이 값은 초기상태와 나중상태만으로 결정되고 변화과정에는 무관한 양이다. 이 W-Q는 두 상태량의 차와 같고 이를 내부에너지라고 한다.
외부에서 열의 흡입이 없고 일도 받지 않았다면, 그 물질계의 에너지는 변하지 않는다. 따라서 물질계의 에너지를 감소시키지 않고 외부에 일을 할 수 있는 장치, 즉 제1종 영구기관은 원리적으로 제작이 불가능하다고 할 수 있다.
이 에너지 보존법칙을 이야기하려면 먼저 열린 계와 닫힌 계를 생각해야 하는데 계란 우리가 관심을 갖고 관찰하려고 하는 우주의 일부분이고 그 나머지는 주위(surrounding)라고 하는데 열린 계란 이 주위를 통해 무언가가 교환이 가능한 것을 말한다.
따라서 우주의 에너지는 보존된다고 말할 때 닫힌 계를 두고 하는 말이다. 이 때 에너지 보존의 법칙은 다음과 같이 풀어 말할 수 있다.
"우주가 처음 생길 때 일정한 양의 에너지가 주어졌다. 이 에너지는 질량과 변환되지만 전체로는 불변이다. 이 일정한 에너지를 가지고 우주는 살림을 꾸려 나간다. 우주의 일부를 떼어놓고 외부와 차단된 닫힌 계로 생각한다면 그 안에 어떤 물리 화학적 변화가 일어나더라도 그 계의 에너지는 보존된다. "
나. 열역학 제2 법칙
끓는 물 0.1Kg 과 얼음 0.1Kg을 섞으면 약 섭씨 10도의 물 0.2Kg이 된다. 이것은 자연스러운 과정이다. 그러나 나중에 돌아가 보니 물이 0.1Kg의 얼음과 0.1Kg의 물로 변했다면 이는 놀라운 일이다.
이것은 열역학 제1법칙에는 어긋나지 않는다. 그러나 자연스럽게 이런 일은 일어나지 않는다. 즉 열에는 흐르는 진행 방향이 있다.
클라우지우스((Clausius, Rudolf Julius Emanuel, 1822 -1888)는 1850년 열 분포의 변화에 의하여 동력을 얻을 수 있다는 카르노의 견해를 J. P.줄과 J. R.마이어가 세운 ‘열과 일의 당량(當量) 관계의 원리’와 결부시켜, 열은 외부에서 대가를 치르지 않고는 차가운 물체에서 뜨거운 물체로 옮겨지지 않는다는 열역학 제2법칙을 정식화(定式化)하였다.
열역학 제1법칙이 과정의 전과 후에서의 에너지를 양적(量的)으로 규제하고 있는 데 대하여, 제2법칙은 에너지가 흐르는 방향을 규제하는 성격을 띠고 있다.
이 법칙에 의하면 열은 고온부에서 저온부로 흐르는 것이며 저온부에서 고온부로 흐르지는 않는다.
자연현상 가운데는 이와 같은 비가역적 과정이 많다. 예컨대 마찰에 의한 열의 발생, 기체의 확산 등은 주위에 아무 변화도 주지 않고, 이것을 역으로 진행시켜 원래의 상태로 되돌릴 수는 없다.
또 열기관에서는 고온의 열원에서 열을 얻어 이 열의 일부를 냉각기 같은 저온열원으로 흘려보내는 과정에서만 일을 할 수 있고, 고온에서 얻은 열을 전부 일로 바꿀 수는 없다. 따라서 다만 하나의 열원에서 열을 받아 이것을 일로 바꾸되 그 외에 어떤 외부의 변화도 일으키지 않는 열기관, 즉 제2종 영구기관은 원리적으로 제작이 불가능하다고 할 수 있다.
한편 물체의 상태만으로 결정되는 엔트로피라는 양을 정의하고, 이것으로 제2법칙에 대해, ‘열의 출입이 차단된 고립계에서는 엔트로피가 감소하는 변화는 일어나지 않고 항상 엔트로피가 증가하는 방향으로 변하고, 결국에는 엔트로피가 극대값을 가지는 평형상태에 도달한다’제2 법칙을 설명할 수도 있다.
3. 엔트로피
물질계(物質系)의 열적 상태(熱的狀態)를 나타내는 물리량의 하나이다.
1865년 클라우지우스가 변화를 뜻하는 그리스어 τροπη에서 이 물리량을 엔트로피라 이름하였다. 이론적으로는 물질계가 흡수하는 열량 dQ와 절대온도 T와의 비 dS=dQ/T로 정의한다.
여기서 dS는 물질계가 열을 흡수하는 동안의 엔트로피 변화량이다. 열기관(熱機關)의 효율을 이론적으로 계산하는 이상기관에서는 모든 과정이 가역과정이므로 엔트로피는 일정하게 유지되지만 일반적으로 현상이 비가역 과정인 자연적 과정을 따르게 될 때에는 이 양은 증가하고 자연적 과정에 역행할 때에는 감소하는 성질이 있다. 즉 자연현상의 변화가 자연적 방향을 따라 발생하는가를 나타내는 척도로 다루어진다.
대부분 자연현상의 변화는 어떤 일정한 방향으로만 진행한다. 즉, 열이 낮은 온도에서 높은 온도로 흐르거나, 아무런 다른 변화 없이 열이 일로 바뀌는 것은 사람들의 경험을 통해 과거에 한 번도 일어난 일도 없고 앞으로도 일어나지 않을 것으로 사실상 확신할 수 있는 일들이다.
그러나 그것들이 이론적으로 불가능하다고 증명된 일은 없다. 따라서 일어날 수도 있지만 그 확률이 극히 낮아서 관측하기 불가능하다고 보는 것이 나을 것이다. 그렇다면 열역학 제2법칙이 제시하는 변화의 방향성, 예를 들어 열이 높은 온도에서 낮은 온도로 흐르는 것은 그 방향으로 변화가 일어날 확률이 지극히 높음을 이야기하는 것이다.
또한 자연현상의 변화는 물질계의 엔트로피가 증가하는 방향으로 진행한다는 말은 엔트로피가 증가하는 변화가 일어날 확률이 지극히 높다는 것이 된다.
어떤 한 상태(상태1)에서 다른 한 상태(상태2)로의 변화가 항상 일어나기 위해서는 상태2가 상태1보다 확률이 지극히 높은 상태라야 한다. 결국 엔트로피는 이와 같이 확률과 연관되어 있다.
어떤 상태에 대한 엔트로피는 그 상태에 대한 확률의 척도일 뿐 아니라 ,또한 그 상태에 대한 무질서함(randomness)의 척도이기도 하다. 어떤 계의 무질서한 상태(예를 들어, 기체 상태)에 해당하는 분자들의 배열 방법 수는 매우 많고, 그대 대한 확률이 큰데 반해 질서가 있는 상태(예를 들어 고체 상태)에 대한 배열 방법 수와 그 확률은 극히 작기 때문이다.
52장의 카드놀이를 생각할 때 아무렇게나 섞여 있는 상태(무질서)와 다이아몬드 12장이 순서대로 끼어 있는 생태(질서 있는 상태)는 후자의 확률이 훨씬 작다는 것을 알 것이다.
카드를 아무렇게나 몇 번 치고 있으면 점차 확률이 큰 쪽으로 가게 된다. 10의 20제곱이 훨씬 넘는 분자들로 이루어진 기체계의 분자배열에서는 그 정도가 얼마나 심하겠는가? 여기서는 역행하는 확률이 거의 나타나지 않는다.
잘 정돈된 진열장에서 유리컵이 떨어져 깨질 확률은 크지만 그 파편이 다시 모아서 온전한 유리컵이 될 확률은 거의 없다.
다시 말하면 엔트로피는 무엇보다도 물질계의 열적 상태로부터 정해진 양으로서, 통계역학의 입장에서는 열역학적인 확률을 나타내는 양으로 엔트로피 증가의 원리는 분자운동이 확률이 적은 질서 있는 상태로부터 확률이 큰 무질서한 상태로 이동해 가는 자연적 현상으로 해석된다.
예를 들면, 마찰에 의한 열이 발생하는 것은 역학적 운동(분자의 질서 있는 운동)이 열운동(무질서한 분자운동)으로 변하는 과정이며 고온 물체에서 저온 물체로 열이 이동하는 것은 국부적으로 분자운동에 개별성이 있다고 하는 질서 있는 상태에서 분자운동이 균일해지는 무질서상태로 이동해 가는 것이다.
이들은 어느 경우에나 엔트로피가 증가하지만 그 반대의 과정은 무질서에서 질서로 옮겨가는 것이며 이 과정은 자발적으로 일어나지 않는다.
일반적으로 열역학적 확률의 최대값은 온도가 균일한 열 평형상태에 대응하는 것으로서, 고찰하고 있는 물질계가 다른 에너지의 출입이 없는 고립계(孤立系)인 경우에는 늦던 빠르던 전체가 열 평형에 도달하여 모든 열 과정이 정지하는 것이라고 생각된다.
이로부터 엔트로피 증가의 법칙이 발표된 직후 만약 이 법칙이 정당하다면 우주는 어느 것이나 열 평형에 도달하여 모든 종류의 에너지가 분자의 불규칙적인 열 운동으로 변하여, 열의 종말, 즉 우주의 종말에 도달하게 될 것이라는 논쟁이 일어났다. 그러나 이는 우주를 고립된 유한한 계라고 가정했을 때의 결론이다.
구체적인 예를 들어보자. 어떤 시스템의 엔트로피의 변화는 시스템에 가해진 열을 그 시스템의 절대온도로 나눈 값을 말한다. 식으로 쓰면 다음과 같다.
△S ≥ Q / T
예를 들어 600도의 물체에서 300도의 물체로 3000Kcal의 열이 이동했다면
600도 물체의 엔트로피의 변화는 -3000/600 = -5 Kcal/Kelvin (감소)
300도의 물체의 엔트로피의 변화는 +3000/300 =+10 Kcal/Kelvin (증가)
그래서 전체적인 엔트로피의 증가는 10 - 5 = 5 Kcal/Kalvin 가 된다.
연속적인 운전에 의하여 에너지를 창출하는 기계장치(제1종 영구기관) 및 열을 모두 남김없이 일로 변환하는 기계장치(제2종 연구기관) 등은 각각 열역학 제1법칙 및 제2법칙에 위배되어 실제로는 제작할 수 없다.
에너지 보존에 어긋나는 열기관을 만들 수 없는 것처럼 열역학 제2법칙에 어긋나는 열기관, 즉 엔트로피를 감소시키는 열기관은 만들 수 없다. 예를 들어 600도의 물체에서 300도의 물체에 3000Kcal의 열 이동을 하는데 1800Kcal의 열을 빼내서 일로 바꾸는 열기관이 있었다고 하자.
600도 물체의 엔트로피 변화는 -3000/600 = -5 Kcal/Kelvin
300도 물체의 엔트로피 변화는 +(3000-1800)/300 = +4 Kcal/Kalvin
그래서 전체적인 엔트로피의 변화는 -5 + 4 = -1이 된다.
즉 이런 열효율 기관을 있을 수 없다. 이 때는 외부에서 어떤 변화가 있어야 한다. 즉 저온부에서 고온부로 열이 이동한다고 하는 자연현상에 역행하는 과정, 예를 들면 냉동기의 저온부에서 열을 빼앗아 고온부로 방출하는 과정에서는 확실히 국부적으로 엔트로피가 감소하지만, 이것에는 냉동기를 작동시키는 모터 내에서 전류가 열로 바뀐다고 하는 자연적 과정이 필연적으로 동반되므로 전체로서는 엔트로피가 증가하는 것을 확인할 수 있다.
마찬가지로 역학적 일이 열로 바뀌는 과정은, 엔트로피가 증가하는 자연적 과정이지만, 열이 역학적 일로 바뀌는 것은 비자연적인 것으로, 이것은 열의 일부가 저온부(예컨대 바깥 공기 등)를 데운다고 하는 자연적 과정이 선행되기 때문이다.
요컨대 자연현상은 때때로 국부적인 부분의 엔트로피가 감소하는 비자연적 변화를 따르는 것도 있지만, 그것에 관계되는 물질계 전체를 다루어 보면, 항상 엔트로피를 증가시키는 방향으로 현상이 변화한다.
이 이론은 자연현상이 일어나는 방향을 정하는 것으로서, 에너지보존법칙과 함께 열역학의 기본법칙으로 중요하다. 이상기체에서 엔트로피가 증가하지 않는 것은 가역변화라고 하는 비현실적인 변화를 가정하고 있기 때문이다.
. 엔트로피에 관한 퀴즈
건물을 가만히 놔두면 건물은 서서히 무너지기 시작한다. 얼마나 오랜 세월이 걸릴질 모르지만 언젠가는 무너진다. 즉 무질서도가 증가한다. 이와같이 엔트로피에 대한 개념은 상당히 쉬운 개념임에도 이해하기가 어려운 경우가 많다.
그림은 엔트로피 라는 이름을 가진 회사가 「우리는 엔트로피를 증가시키는 일을 하는 회사」라는 표어를 걸고 크레인으로 건물을 분쇄하는 일을 하고 있다. 대충 보면 맞는 말이기도 하다. 건물을 부수는 것은 건물의 입장에서 무질서도 즉 엔트로피가 증가하는 일임에 틀림없기 때문이다. 정말 이 과정에서 엔트로피는 증가하는 것일까?
해석:

하지만 이 그림을 자세히 따져본다면 건물의 엔트로피가 꼭 증가한다고만은 말할 수 없다. 엔트로피회사의 크레인은 건물을 부수기 위해 건물에 쇠추를 부딪치는 방법을 쓴다. 이때 쇠추의 운동에너지의 일부분은 건물에 전달되어 건물을 부수지만 또 일부분은 소리에너지나 작지만 빛에너지 그리고 건물에 열에너지로 전달된다. 따라서 건물은 쇠추의 충돌로 인해 외부로부터 열을 얻는 셈이다.
그러면 건물의 엔트로피는 꼭 증가한다고 말할 수 없게 되고 엔트로피회사의 표어는 틀린 셈이다. 물론 크레인은 그냥 움직이는 것이 아니고 연료를 소모하며 그 소모되는 작용에서는 엔트로피가 증가한다. 건물과 크레인의 전체계에서 보더라도 전체 엔트로피는 증가한다. 하지만 앞서 말한 것과 같이 크레인이 건물을 부수는 일이 꼭 엔트로피를 증가시키는 일만 있는 것은 아니다.
[종합 정리]
1. 위치에너지와 운동에너지는 어떤 것이며 어떤 수식으로 주어지는가?
2. 열역학 제1법칙이란 무엇인가?
3. 열역학 제2 법칙이란 무엇인가?
4. 엔트로피란 무엇인가?
5. 무기물에서 아메바로, 원숭이로, 인간으로 진화했다는 것은 엔트로피 이론과 모순되는가?
'자유 게시판' 카테고리의 다른 글
| [poem] - 단단한 뼈 / 이영옥 (0) | 2021.01.14 |
|---|---|
| 인간의 화석은 왜 발견되지 않을까? (0) | 2021.01.13 |
| 전기와 자기 그리고 스핀 (0) | 2021.01.12 |
| [정보.동향] - '코로나 사피엔스' 관련 동향 (0) | 2021.01.11 |
| [에너지 혁명] - ' 핵 융합 발전소와 그린 수소 에너지 ' (0) | 2021.01.11 |